A respeito da publicação do Posicionamento sobre a Segurança Cardiovascular das Vacinas contra COVID-19 – 2022, publicado na Revista , por Moreira et al (1). É importante avaliarmos com clareza a situação das vacinas de mRNA, no contexto da vida real. A despeito dos “raros” efeitos adversos reportados por inúmeros autores, normalmente autodeclarados de interesses conflituosos, a raridade parece não ser transposta dos estudos controlados pela indústria farmacêutica, para aqueles da “Vida Real”.
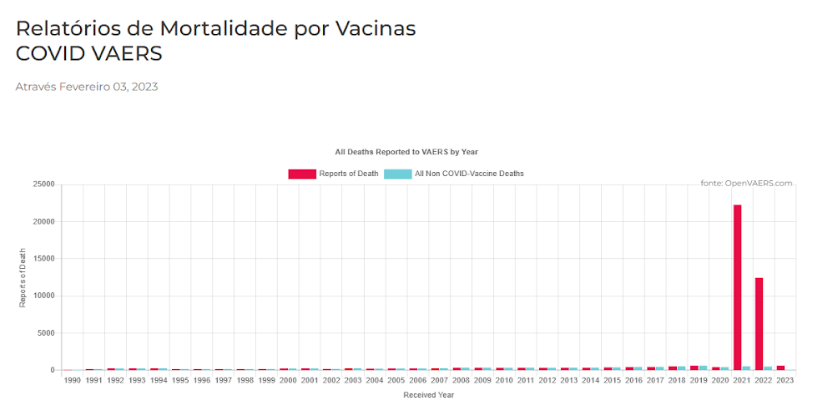
No texto introdutório deste posicionamento, fica implícito a equiparação de segurança entre as vacinas COVID-19 e as demais. Uma pesquisa no site do Sistema de notificação norte-americano de eventos adversos da vacina (VAERS, Vaccine Adverse Event Reporting System)(2), é capaz de demonstrar a insegurança comparativa entre os as vacinas contra o COVID-19 e os demais imunizantes. O gráfico abaixo (Gráfico 1), mostra que em dois anos de vacinação contra o COVID-19, houve 3,5 vezes mais notificações de óbitos atribuídos a estas vacinas do que a todas outras vacinas juntas, nos últimos 33 anos. São 34.270 notificações de mortes em dois anos, contra 9741 em trinta e três anos. Isto torna incoerente qualquer tipo de equiparação de perfil de segurança. Além disto, não há clareza ainda quanto ao acompanhamento dos efeitos adversos de médio e longo prazo e também quanto a transparência e publicidade dos dados brutos dos ensaios clínicos da vacina COVID-19, pelo fato de não estarem disponíveis (3) (4).
Outro ponto controverso, do posicionamento em discussão, é considerar as vacinas como efetivas no controle da pandemia pelo vírus. Isto estimula uma falsa segurança na população exposta, pois ignora-se a ineficácia destes produtos em conter a transmissibilidade do vírus SARS-CoV-2.
Singanayaman et al. (5) avaliando prospectivamente a transmissão comunitária de SARS-CoV-2 entre indivíduos não vacinados e indivíduos vacinados mostrou que o impacto da vacinação na transmissão das variantes circulantes de SARS-CoV-2 na comunidade parece não ser significativamente diferente do impacto entre pessoas não vacinadas. Concluem ainda, que a vacinação não evita a transmissão.
A diretora da Pfizer, Sra Janine Smalls, após indagação do eurodeputado Rob Roos, em Comitê Especial sobre a Pandemia de Covid-19, admitiu que a vacina da empresa nunca foi testada contra a transmissibilidade antes da comercialização. Não obstante, a enxurrada de publicações desmentindo esta fala, pelas agências de checagem de fatos, a própria empresa manifestou-se a respeito:
Em nota, a assessoria disse que o “estudo clínico de Fase 3 (protocolo publicado em novembro de 2020) foi desenhado para avaliar a eficácia do imunizante BNT165b2 na prevenção da doença causada pelo SARS-CoV2, incluindo quadros graves. Os estudos do imunizante BNT165b2 (ComiRNAty) não foram desenhados para avaliar a eficácia da vacina contra a transmissão do SARS-CoV-2″ (6). Desta forma, não parece razoável aceitarmos premissas sabidamente erradas, que no contexto atual da politização da pandemia, podem ser utilizadas como base para conclusões falsas e imposições à sociedade.
A despeito dos números das várias publicações citadas por Moreira et al (1), a respeito da incidência de “raros” efeitos adversos, relacionados as injeções de mRNA, exemplificada especificamente por duas entidades nosológicas, Trombose com trombocitopenia imune induzida por vacina (VITT) e Miocardite induzida por vacina, estes autores consideraram que os benefícios da vacinação superam os riscos. Entretanto, não citaram de forma precisa a faixa etária que goza deste benefício e quais são estes benefícios.
Diferentes opiniões parecem ter Fraiman et al. (7). Em seu estudo que analisou secundariamente os eventos adversos graves relatados nos ensaios clínicos randomizados de fase III controlados por placebo das vacinas Pfizer e Moderna mRNA COVID-19 em adultos (NCT04368728 e NCT04470427), considerando os eventos adversos de interesse especial da Brighton Collaboration concluíram que o excesso de risco de eventos adversos graves encontrados, aponta para a necessidade de melhores análises de dano-benefício.
As vacinas de mRNA, combinadas, foram associadas a um risco excessivo de eventos adversos graves de interesse especial de 12,5 por 10.000 vacinados, ou seja, UM EFEITO ADVERSO GRAVE PARA CADA 800 PESSOAS VACINADAS. Observa-se que a incidência de efeitos adversos graves, aumenta muito se não restringirmos a análise apenas a trombose e miocardite.
Com base na apresentação da Agência de Segurança da Saúde do Reino Unido (UKHSA) ao Comitê Conjunto de Vacinação e Imunização (JCVI) em 25 de outubro de 2022 (8), considerando pessoas com mais de 70 anos, ficou evidenciado que o número necessário de vacinas (VNN), para evitar-se uma hospitalização é de 7500 (Tabela 1), considerando a terceira dose. Isto significa que é preciso aceitar 1 efeito adverso grave para cada 800 vacinações, para se ter o benefício de 1 hospitalização evitada em 7500 imunizações (terceira dose) em pessoas com mais de 70 anos. Isto representa pelo menos nove vezes mais risco de efeito adverso grave do que hospitalização evitada.
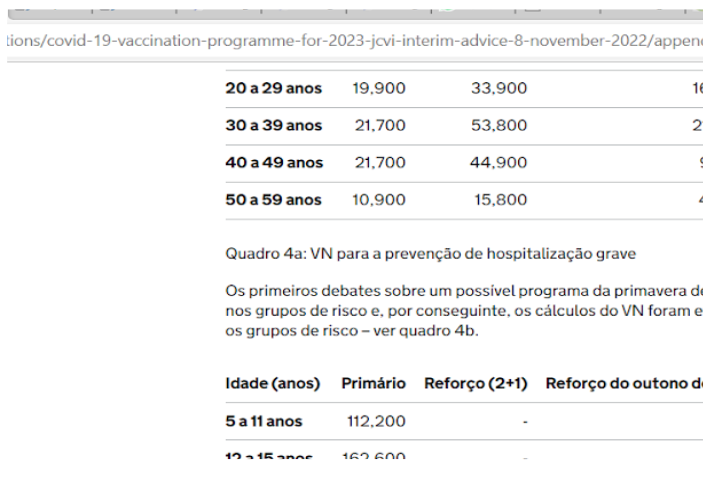
Este VNN torna-se progressivamente mais alto quando comparamos faixas etárias mais jovens. Isto torna ainda maior o RISCO em relação ao BENEFÍCIO de tal procedimento. Se considerarmos a idade de 5 a 11 anos e a primeira dose apenas, precisaríamos de 112.200 doses para evitar 1 hospitalização. Lembrando, em 800 doses teríamos 1 efeito adverso grave, isto significa 140 vezes mais efeitos adversos graves do que hospitalizações evitadas nesta faixa etária.
Fraiman et al. (7), também relataram limitações às suas conclusões, devido às dificuldades de acesso aos dados brutos dos ensaios clínicos, considerou que a incidência de efeitos adversos graves pode ainda estar subestimado devido a sua possível subcontagem no estudo da Pfizer, pela não inclusão dos efeitos adversos ocorridos após 30 dias da injeção. Apesar destes autores fazerem uma análise secundária, reanálises de dados de ensaios clínicos, no passado, levaram à detecção de eventos adversos após a entrada no mercado de medicamentos importantes, como rofecoxibe e rosiglitazona (9), (10).
A segurança cardiovascular destas vacinas é incerta. As exigências e imposições da vacinação (Covid -19) a qualquer custo, pode expor a população aos riscos de complicações ainda desconhecidas. Sun, Jafe & Levi (11), compilaram as chamadas telefônicas por parada cardíaca (PC) e síndrome coronariana aguda (SCA) recebidas pelo Serviço Médico de Emergência Nacional de Israel, ao longo de dois anos e meio, que abrangem 14 meses antes do início da pandemia de COVID-19, 10 meses que incluem duas ondas da pandemia de COVID 19 e 6 meses com uma terceira onda da pandemia paralela ao lançamento da vacinação para a população de 16 anos ou mais.
Este estudo concluiu que houve um aumento superior a 25% tanto no número de chamadas de PC como de SCA, na faixa etária de 16 a 39 anos, durante a vacinação COVID-19 em Israel (janeiro a maio de 2021), comparado com o mesmo período de tempo em anos anteriores (2019 e 2020). Além disso, ficou evidenciado uma associação robusta e estatisticamente significativa entre as contagens semanais de chamadas PC e SCA e as taxas de 1ª e 2ª doses de vacina administradas a esta faixa etária. O aumento das complicações cardiovasculares, referentes a própria doença – Covid-19, diferentemente do que foi afirmado por Moreira et al (1), não apresentaram significativo aumento com a infecção por COVID-19, especialmente no que se refere aos chamados por PC e SCA.
A não correlação entre estes eventos e a infecção corrobora os achados anteriores que mostraram que aumentos na incidência geral de PC nem sempre foram associados a taxas mais altas de infecções por COVID (12), (13), (14), assim como a ausência de incrementos nas hospitalizações relacionadas ao infarto do miocárdio durante a onda inicial de COVID-19 comparado com as linhas de base pré-pandêmicas em Israel (15).
Esta correlação entre queixas cardiovasculares e campanha de vacinação contra o Covid-19 também são ratificadas por um relatório de aumento de visitas ao pronto-socorro com queixas cardiovasculares durante o lançamento da vacinação na Alemanha (16), bem como o aumento das chamadas ao Serviço de Emergência Médica para incidentes cardíacos na Escócia (17).
Os autores (11) ainda chamam atenção da importância destes dados no contexto da possível subnotificação de miocardite, uma vez que esta é frequentemente diagnosticada erroneamente como síndrome coronariana aguda (18), (19), (20). Na vida real, a miocardite pode ser ainda mais subnotificada, uma vez que o seu diagnóstico preciso, depende de estudo de ressonância nuclear magnética, nem sempre disponível. Além disto, deve-se considerar também, que a miocardite assintomática é uma causa frequente para morte súbita inexplicada entre adultos jovens (21), (22), (23), (24). Fabre & Sheppard (25), concluíram que a miocardite é uma importante causa de morte súbita cardíaca morte em adultos jovens, respondendo por até 12% das suspeitas de morte cardíaca por análise posmorten, o que poderia explicar o aumento de chamadas por parada cardíaca em jovens de 16 a 39 anos, durante a vacinação COVID-19 em Israel, conforme publicado por Sun, Jafe & Levi (11).
Moreira et al. (1) afirmam que a taxa de miocardite associada à COVID-19 excede a taxa observada com as vacinas na maioria dos levantamentos populacionais e citam os resultados de Patone et. al (26), (27). Entretanto, não mencionam que, neste estudo, os pacientes que desenvolveram miocardite após a infecção por SARS- Cov2, também receberam previamente o imunizante, abrindo a possibilidade para um aumento da incidência de miocardite, ocasionada pela sobrecarga antigênica. Além disto, estes autores, avaliaram apenas os casos que tiveram uma internação hospitalar, ou seja, os casos de miocardite assintomáticas ou oligossintomáticas, não aparecem no escopo desta análise.
Tuvali et al (28), que em estudo de coorte retrospectivo de 196.992 adultos após infecção por COVID-19 em pacientes internados do Clalit Health Services em Israel entre março de 2020 e janeiro de 2021, constatou incidência de 0,0046% de miocardite e 0,0056% de pericardite semelhantemente ao que foi identificado para o grupo controle. Os autores concluíram que não foi observado aumento da incidência de pericardite ou miocardite em pacientes adultos que foram internados por COVID-19. O NNH (número necessário para prejudicar) é uma medida importante na medicina baseada em evidências e ajuda os médicos a decidir se é prudente prosseguir com um tratamento específico que pode expor o paciente a danos, proporcionando benefícios terapêuticos.
Um desfecho clínico for devastador o suficiente sem o medicamento (por exemplo, morte, ataque cardíaco), medicamentos com NNH baixo ainda podem ser indicados em situações específicas se o NNT (número necessário para tratar) for menor que o NNH.
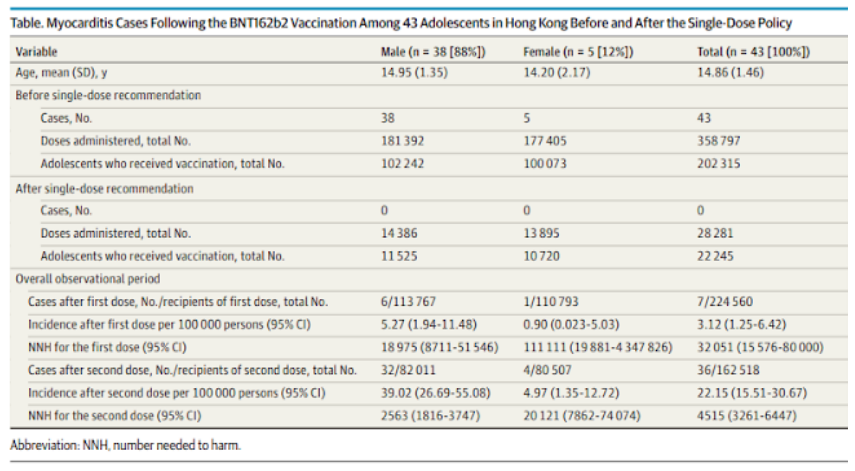
Li et al (29), em um estudo coorte, após o início da vacinação em adolescentes em Hong Kong, considerando apenas miocardite como efeito adverso da vacina (COVID-19 BNT162b2), constataram um NNH para primeira dose de 18.975 para homens, 32.051 para ambos os sexos. Para segunda dose, estes autores encontraram um NNH de 2.563 para homens e 4.515 considerando ambos os sexos (Tabela 2).
Considerando os dados apresentados pela Agência de Segurança da Saúde do Reino Unido (UKHSA) ao Comitê Conjunto de Vacinação e Imunização (JCVI) em 25 de outubro de 2022 (8), que retrata a ação destes imunizantes na vida real, o NNT para se evitar 1 hospitalização, considerando a segunda dose, nas seguintes faixas etárias, seriam:
- 16 -19 anos: 193.500
- 20-29 anos: 418.100
- 30-39 anos: 188.500
Um NNT bem maior que o NNH, visivelmente torna proibitivo a indicação destes imunizantes para estas faixas etárias. Considerando, para fins de cálculos, apenas os adolescentes da faixa etária de 16-19 anos, sem adicionar a exposição desta população aos outros efeitos adversos diferentes da miocardite, como a trombose por exemplo, a análise de risco é representado abaixo:
- 16-19 anos (masculino):
1ª dose – aceitar 10,1 vezes mais miocardite do que internações evitadas
2ª dose – aceitar 75,5 vezes mais miocardite do que internações evitadas
- 16-19 anos (ambos os sexos):
1ª dose – aceitar 6 vezes mais miocardite do que internações evitadas
2ª dose – aceitar 42,8 vezes mais miocardite do que internações evitadas
Oster et. al (30), que analisaram as notificações de miocardites atribuídas a vacinas do Sistema de notificação norte-americano de eventos adversos da vacina (VAERS, Vaccine Adverse Event Reporting System), constataram que a maioria dos casos (82%) foi em indivíduos do sexo masculino. Com relação à BNT162b2 (Pfizer), a incidência foi de 70,6 por cada milhão de doses aplicadas entre homens de 12 a 15 anos; 105,9 por milhão em homens de 16 a 17 anos, e 52,4 por milhão de doses aplicadas em homens de 18 a 24 anos. Extrapolando os cálculos de NNT e NNH, para estes números teria:
- 16-17 anos (masculino) = 20 vezes mais risco de miocardite do que internações evitadas.
- 18-24 anos (masculino) = 21 x mais risco de miocardite do que internações evitadas
Moreira et al (1), citam uma revisão do banco de dados de segurança da AstraZeneca na Europa e no Reino Unido, publicada por funcionários da AstraZeneca (31), que identificou uma incidência de 8,1 casos de VITT por um milhão de primeiras doses, e apenas 2,3 casos por milhão de segundas dose. Para justificar o benefício das imunizações, mesmo contra números extremamente desfavoráveis de efeitos adversos, é advogado que a infecção é pior do que a imunização.
Moreira et al (1), citam autores que reportam incidência de trombose de 8% de todos os pacientes hospitalizados com COVID-19, e até 23% em indivíduos em unidades de terapia intensiva (32). Citam ainda, que há evidências de que a incidência de trombose da veia cerebral em pacientes hospitalizados com COVID-19 foi de 207 por milhão de casos, muito superior à incidência de casos induzidos por vacina (0,9 a 3,8 por milhão) (33).
A comparação de pacientes expostos ao risco de formas graves da doença com a população geral é inadequada. Seria mais coerente individualizar as faixas etárias, os grupos de risco e as variantes virais circulantes. São inúmeras variáveis a serem consideradas, que certamente influenciariam na avaliação de risco e benefício. Um paciente idoso, com morbidades associadas, infectado pela variante P1, hospitalizado, está certamente exposto a um risco maior de trombose quando comparado a uma criança ou adolescente ou ainda indivíduo jovem saudável, especialmente quando infectados pelas variantes atuais, que sabidamente causam menos inflamação e consequentemente internações e complicações trombóticas.
A segurança cardiovascular das vacinas contra o COVID-19 é, no mínimo, incerta. Não há estudos randomizados desenhados para avaliar este risco, portanto este posicionamento que atesta a segurança destes imunizantes pode provocar mais dano do que benefício à sociedade.
Bibliografia
1.Moreira HG, Oliveira Júnior MT, Valdigem BP, Martins CN, Polanczyk CA. Posicionamento sobre Segurança Cardiovascular das Vacinas contra COVID-19 – 2022. Arq Bras Cardiol. 2022; 118(4):789-796
2. https://openvaers.com/covid-data/mortality
3. Tanveer S, Rowhani-Farid A, Hong K, Jefferson T, Doshi P. Transparency of COVID-19 vaccine trials: decisions without data. BMJ Evid Based Med [Internet]. 2021 Aug 9; Available from: http://dx.doi.org/10.1136/bmjebm2021-111735.
4. Doshi P, Godlee F, Abbasi K. Covid-19 vaccines and treatments: we must have raw data, now. BMJ [Internet]. 2022 Jan 19;376:o102. Available from: http:// dx.doi.org/10.1136/bmj.o102
5. Singanayaman A, Hakki S, Dunning J, et al. Community transmission and viral load kinetics of the SARS-CoV-2 delta (B.1.617.2) variant in vaccinated and unvaccinated individuals in the UK: a prospective, longitudinal, cohort study. Lancet Infect Dis 2021; published online Oct 29. https://doi. org/10.1016/S1473-3099(21)00648-4
6. Vacina da Pfizer: Fala de diretora sobre falta de testes é distorcida (uol.com.br)
7. Fraiman J. et al. Serious adverse events of special interest following mRNA COVID-19 vaccination in randomized trials in adults. Vaccine 40 (2022) 5798–5805.
9. Krumholz HM, Ross JS, Presler AH, Egilman DS. What have we learnt from Vioxx? BMJ 2007;334(7585):120–3. https://doi.org/10.1136/ bmj.39024.487720.68.
10. Nissen SE, Wolski K. Effect of Rosiglitazone on the Risk of Myocardial Infarction and Death from Cardiovascular Causes. N Engl J Med 2007;356 (24):2457–71. https://doi.org/10.1056/NEJMoa072761.
11. Sun CLF, Jafe J and Levi R. Increased emergency cardiovascular events among under-40 population in Israel during vaccine rollout and third COVID-19 wave. Scientifc Reports (2022) 12:6978. https://doi.org/10.1038/s41598-022-10928-z
12. Sun, C., Dyer, S., Salvia, J., Segal, L. & Levi, R. Worse cardiac arrest outcomes during the COVID-19 pandemic in Boston can be attributed to patient reluctance to seek care: Study examines cardiac arrest outcomes among Boston patients during the COVID-19 pandemic. Health Af https://doi.org/10.1377/hlthaf.2021.00250 (2021).
13. Chan, P. S. et al. Outcomes for out-of-hospital cardiac arrest in the United States during the coronavirus disease 2019 pandemic. JAMA Cardio. 6, 296–303 (2021).
14. Uy-Evanado, A. et al. Out-of-hospital cardiac arrest response and outcomes during the COVID-19 pandemic. Clin. Electrophysiol. 7, 6–11 (2021)
15. Fardman, A. et al. Acute myocardial infarction in the Covid-19 era: Incidence, clinical characteristics and in-hospital outcomes—A multicenter registry. PLoS ONE 16, e0253524 (2021).
16. Team, S (Robert Koch-Institut, 2021).
17. Public Health Scotland – COVID-19 wider impacts on the health care system. https://scotland.shinyapps.io/phs-covid-wider-impact/
18. Kern, J., Modi, R., Atalay, M. K. & Kochilas, L. K. Clinical myocarditis masquerading as acute coronary syndrome. J. Pediatr. 154, 612–615 (2009).
19. Monney, P. A. et al. Acute myocarditis presenting as acute coronary syndrome: Role of early cardiac magnetic resonance in its diagnosis. Heart 97, 1312–1318 (2011).
20. Muneuchi, J. et al. Myocarditis mimicking acute coronary syndrome following infuenza B virus infection: A case report. Cases J. 2, 1–4 (2009).
21. Feldman, A. M. & McNamara, D. Myocarditis. N. Engl. J. Med. 343, 1388–1398 (2000).
22. Ali-Ahmed, F., Dalgaard, F. & Al-Khatib, S. M. Sudden cardiac death in patients with myocarditis: Evaluation, risk stratifcation, and management. Am. Heart J. 220, 29–40. https://doi.org/10.1016/j.ahj.2019.08.007 (2020).
23. Drory, Y. et al. Sudden unexpected death in persons less than 40 years of age. Am. J. Cardiol. 68, 1388–1392. https://doi.org/10. 1016/0002-9149(91)90251-f (1991).
24. Chu, P.-L., Chang, W.-T., Chen, W.-J. & Chen, Y.-S. Acute viral myocarditis presenting as sudden cardiac arrest and refractory ventricular tachycardia. Am. J. Emerg. Med. 22, 628–629. https://doi.org/10.1016/j.ajem.2004.09.017 (2004).
25. Fabre A, Sheppard MN. Sudden adult death syndrome and other nonischaemic causes of sudden cardiac death. Heart 2006;92(3):316–320.
26. Patone M, Mei XW, Handunnetthi L, Dixon S, Zaccardi F, Shankar-Hari M, et al. Risk of Myocarditis Following Sequential COVID-19 Vaccinations by Age and Sex. medRxiv. Published online December 25, 2021. doi:10.1101/2021.12.2 3.21268276
27. Patone M, Mei XW, Handunnetthi L, Dixon S, Zaccardi F, Shankar-Hari M, et al. Risk of Myocarditis Following Sequential COVID-19 Vaccinations by Age and Sex. medRxiv. Published online December 25, 2021. doi:10.1101/2021.12.2 3.21268276
28. Tuvali, O.; Tshori, S.; Derazne, E.; Hannuna, R.R.; Afek, A.; Haberman, D.; Sella, G.; George, J. The Incidence of Myocarditis and Pericarditis in Post COVID-19 Unvaccinated Patients—A Large Population-Based Study. J. Clin. Med. 2022, 11, 2219. https://doi.org/ 10.3390/jcm11082219
29. Li X., Lai F.T.T. and Wong I.C.K, Myocarditis Following COVID-19 BNT162b2 Vaccination Among Adolescents in Hong Kong. JAMA Pediatr. 2022 Jun; 176(6): 612–614.
30. Oster ME, Shay DK, Su JR, Gee J, Creech CB, Broder KR, et al. Myocarditis Cases Reported After mRNA-Based COVID-19 Vaccination in the US From December 2020 to August 2021. JAMA. 2022;327(4):331-40. doi: 10.1001/ jama.2021.24110.
31. Bhuyan P, Medin J, Silva HG, Yadavalli M, Shankar NK, Mullerova H, et al. Very Rare Thrombosis with Thrombocytopenia after Second AZD1222 Dose: A Global Safety Database Analysis. Lancet. 2021;398(10300):577-8. doi: 10.1016/S0140-6736(21)01693-7.
32. Nopp S, Moik F, Jilma B, Pabinger I, Ay C. Risk of Venous Thromboembolism in Patients with COVID-19: A Systematic Review and Meta-Analysis. Res Pract Thromb Haemost. 2020;4(7):1178-91. doi: 10.1002/rth2.12439.
33. Bikdeli B, Chatterjee S, Arora S, Monreal M, Jimenez D, Krumholz HM, et al. Cerebral Venous Sinus Thrombosis in the U.S. Population, after AdenovirusBased SARS-CoV-2 Vaccination, and After COVID-19. J Am Coll Cardiol. 2021;78(4):408-11. doi: 10.1016/j.jacc.2021.06.001.


